当社は設立以来、ヒトiPS細胞由来の再生医療等製品の開発・商業化及び当社独自の設計コンセプトに基づくラボ一体型の商業用細胞培養加工施設「CLiC-1」を利用した製造開発受託(CDMO)事業(以下「CDMO事業」)を通じて、世界中のひとびとの健康と人生に貢献する新たな医療を作り出していくことを主たる事業目的としております。
ヒトiPS細胞由来心筋細胞シートは、iPS細胞から心筋細胞への分化誘導(※1)を経て、大量作製及びシート化等の独自技術を用いて作製するもので、現在の内科的治療では治癒しない重症心不全の治療を目的とした再生医療等製品です。
また、当社の作製するヒトiPS細胞由来心筋細胞シートは、他の再生医療等製品(研究開発中の再生医療等製品を含む)と比べ、構成する細胞数が多いため、iPS細胞を大量にかつ同時に心筋細胞へ分化誘導することは高い難易度が要求されます。当社は、iPS細胞を大量の心筋細胞に分化誘導を行い、残存する未分化の細胞を検出限界以下のレベルまで高度に除去することにより、心筋細胞を高純度に精製するという技術を有しています。これらの細胞培養技術を活用して、ベンチャー企業等へのCDMO事業を行っております。これにより、ベンチャー企業としては独自性の高い事業構成を有しており、当社再生医療等製品承認前にも関わらず売上を計上しております。
(1)事業モデル
当社は、自社研究、大学等の研究機関及び大手製薬企業等との共同研究を通じて、心臓及びそれ以外の領域に係る再生医療等製品の提供及びCLiC-1を利用したCDMO事業を行っております。当社の主要な製品であるヒトiPS細胞由来心筋細胞シートの事業モデルは、大学、大手製薬企業との共同研究を通じて得られた発明、ノウハウ等の成果物に対しては、当社が実施権の許諾を受け製造販売を行うというものです。大阪大学から取得した再実施許諾権付の独占的実施権及び第一三共株式会社と当社の間で締結した共同研究開発契約から発生した成果物及び第一三共株式会社が保有しているシート化精製技術等を組合せ、ヒトiPS細胞由来心筋細胞シートの製造・販売を行う事業です。
また、CDMO事業は、当社のヒトiPS細胞由来心筋細胞の培養技術、精製技術等で取得した経験を生かし、主としてベンチャー企業へのプロセス開発支援に加え、受託製造による細胞及び原材料としての各種細胞を提供するものです。
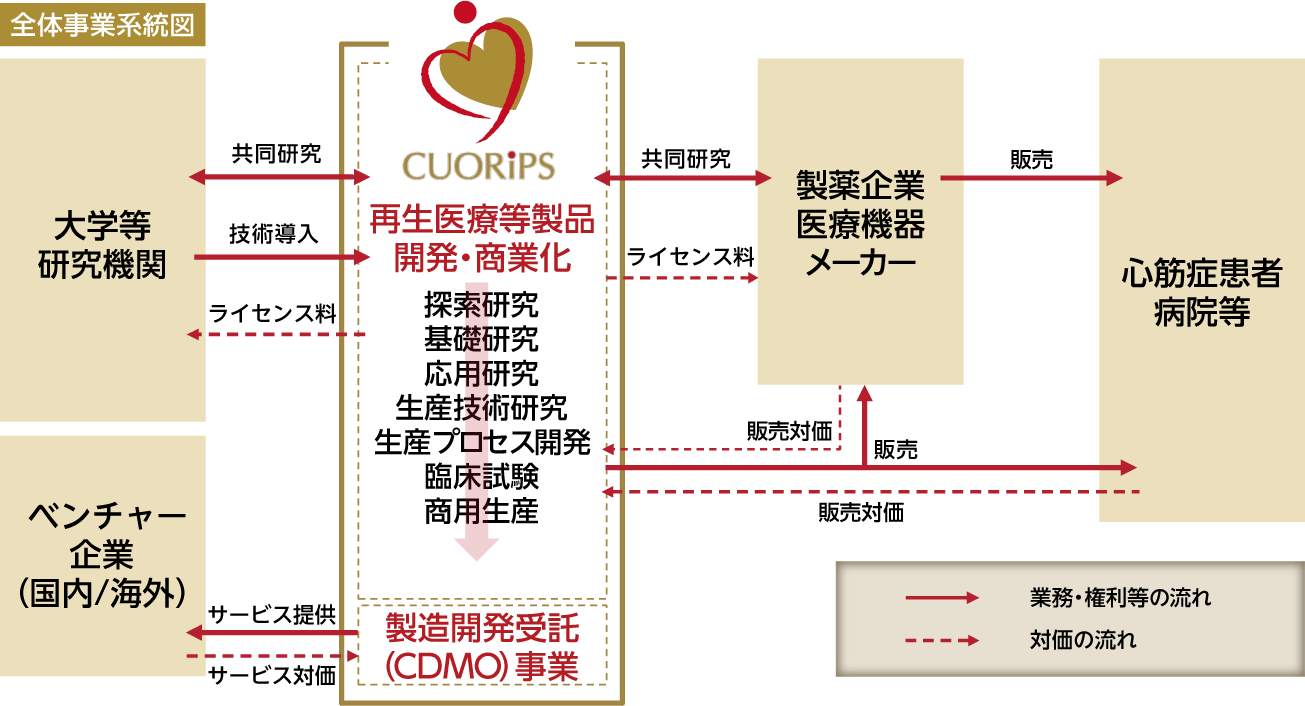
(2)当社事業モデルの特徴
(ⅰ)大阪大学との共同研究開発により培った開発ノウハウ
当社は2017年の設立以来、大阪大学に最先端再生医療学共同研究講座を設置し、ヒトiPS細胞を用いた重症心不全治療の実用化を目的とした共同研究開発を実施しております。共同研究講座は、大学が企業等から資金や研究者を受け入れて、学内に複数の常勤教員を含む独立した研究組織を設置し共同研究を行うというもので、より柔軟かつ迅速に研究を推進することが可能です。
大阪大学は、日本有数の心臓移植手術実績を有しており、当社取締役であり大阪大学大学院医学系研究科の澤芳樹教授((現)名誉教授)は心臓手術数1,000件超、心臓移植数100例超、人工心臓手術数400例超の実績を有します。また基礎研究から臨床応用まで20年以上の実績と幅広いノウハウを保持し、さらには骨格筋芽細胞(※2)シートの発明や開発実績があります。したがって、大阪大学の豊富な経験と確かな技術を基盤とすることでスムーズな応用研究及び臨床開発の推進が可能となります。
(ⅱ)大手製薬企業、医療機器メーカー等との共同研究開発アライアンス
当社は、2017年9月に第一三共株式会社と共同研究開発契約を締結しております。
本共同研究開発の目的としては、大阪大学大学院医学系研究科において開発されたヒトiPS細胞由来心筋細胞の製造及びシート化技術と、第一三共株式会社の有するヒトiPS細胞由来心筋細胞の精製技術を融合した再生医療製品を販売するため、a.心不全治療に用いる商業化可能なヒトiPS細胞由来心筋細胞の製造法及びシート化技術の確立、b.非臨床及び臨床試験の実施、c.当該製品の製造販売承認の取得です。
また、朝日インテック株式会社をはじめ次世代の治療モダリティ(※3)の共同開発や、四国計測工業株式会社との大量培養処理技術の共同開発、また、ダイダン株式会社やアース環境サービス株式会社などの専門技術を有する企業等との細胞培養加工施設の実効的かつ効率的な管理技術の共同開発を推進するとともに、海外展開を強力に進めるための原料段階から臨床開発に至るまでのアライアンス構築を積極的に推進してまいります。
(ⅲ)高度な管理技術に基づく最先端の心筋細胞シート製造技術
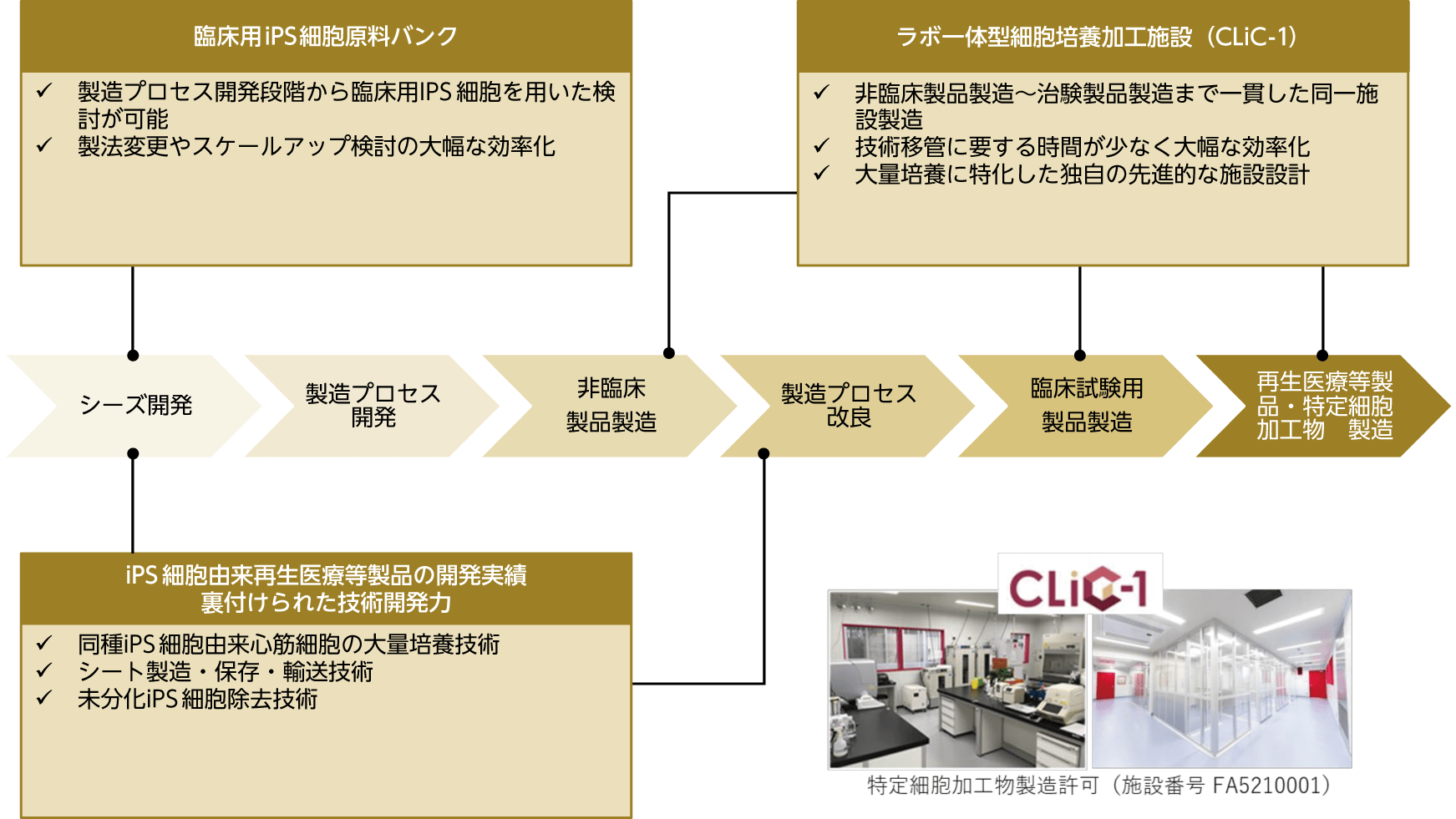
大阪大学による医師主導治験(※4)用の細胞製造や将来的な商業用生産、CDMO事業の拠点として、大阪府箕面市において研究施設を一体化した商業用細胞培養加工施設「CLiC-1」を設置し、2020年8月に稼働を開始しました。本施設は、同グレードの清浄度のクリーンブースを複数並列化する等の独自の設計コンセプトに基づく局所制御技術(※5)を活用することにより大幅なキャパシティ増加を実現した効率的かつ実効的な最先端の細胞培養加工施設(特許出願済み)であり、製造プロセス開発から商用製造まで一貫して対応可能なワンストップな施設となっております。
(ⅳ)シーズから商用生産レベルまで一貫して開発した細胞培養技術ノウハウ
当社は、大阪大学との共同研究開発を通じて、ヒトiPS細胞由来の心筋細胞を用いた再生医療製品の開発と商業化に不可欠な以下の技術を強みとして有しております。
- ヒトiPS細胞の安定的な未分化継代培養
- ヒトiPS細胞の分化誘導、分化細胞作製(特に心筋細胞)
- ヒトiPS細胞由来心筋細胞の高純度精製と未分化細胞除去
- ヒトiPS細胞及び分化細胞の分析、特性評価解析法
(3)当社技術の特徴
① iPS細胞について
iPS細胞は、英語では「induced pluripotent stem cells」と表記され、その頭文字をとって「iPS細胞」と呼ばれています。世界で初めてiPS細胞の作製に成功しノーベル生理学・医学賞を受賞した京都大学の山中伸弥教授により名付けられ、日本語名では「人工多能性幹細胞」と呼ばれます。iPS細胞は、ヒトの体細胞に複数の多能性誘導因子を導入し培養することで作製することができ、ほぼ無限に増殖する能力を持つとともに、様々な組織や臓器の細胞に分化する能力を有します。
② 研究開発の経緯
当社取締役最高技術責任者であり大阪大学大学院医学系研究科の澤芳樹教授((現)名誉教授)らの研究グループは、京都大学の山中伸弥教授と2008年から共同研究を開始し、ヒトiPS細胞を用いた重症心疾患患者の治療法について研究開発を進めてきました。
その間、ヒトiPS細胞由来心筋細胞を用いて、ブタの虚血性心疾患モデル動物の心機能を改善させることに成功し、ヒトiPS細胞由来心筋細胞のサイトカイン(※6)の解析、レシピエント心筋(※7)と電気的・機能的に結合して同期拍動すること等、心機能の改善に関するメカニズムの解析を進めてきました。
そして、京都大学iPS細胞研究所(CiRA)から提供される医療用ヒトiPS細胞ストックを用いて心筋細胞の製造方法を改良することにより、安全性の高い心筋細胞の大量作製及びそのシート化に成功しました。
③ 当社技術の強み
癌化リスクの軽減化
一般的にiPS細胞は癌化するリスクがあると言われますが、最大の原因はiPS細胞が獲得した無限増殖能であり、様々な細胞へ分化誘導するプロセスにおいて目的の細胞に分化せず、未分化な状態のまま数多く残存すると、それだけ癌化するリスクが高まります。当社では、大阪大学と第一三共株式会社の技術を融合し、複数の工程で構成し最適化された独自技術により、2020年1月よりスタートしている医師主導治験において、現段階において癌化した事象の報告を確認しておりません。
低い侵襲性
当社のヒトiPS細胞由来心筋細胞シートは、シート化したヒトiPS細胞由来心筋細胞を患者の心臓の表面に貼付するだけで、穿刺等の心臓に直接的なダメージを与え得る侵襲を伴わないことから、不整脈が発生するリスクを最小限化することを可能にしております。さらに、手術自体もバイパス手術等とは異なり開胸手術ではなく、左肋間に7センチ程度の比較的小さな隙間をあけ、その隙間からシートを挿入するという手術であり、通常のバイパス手術が4時間程度要するのに対し50分程度で完了することが可能で、患者への侵襲を限りなく小さくするとともに執刀医の負担も大幅に軽減されることが期待されます。
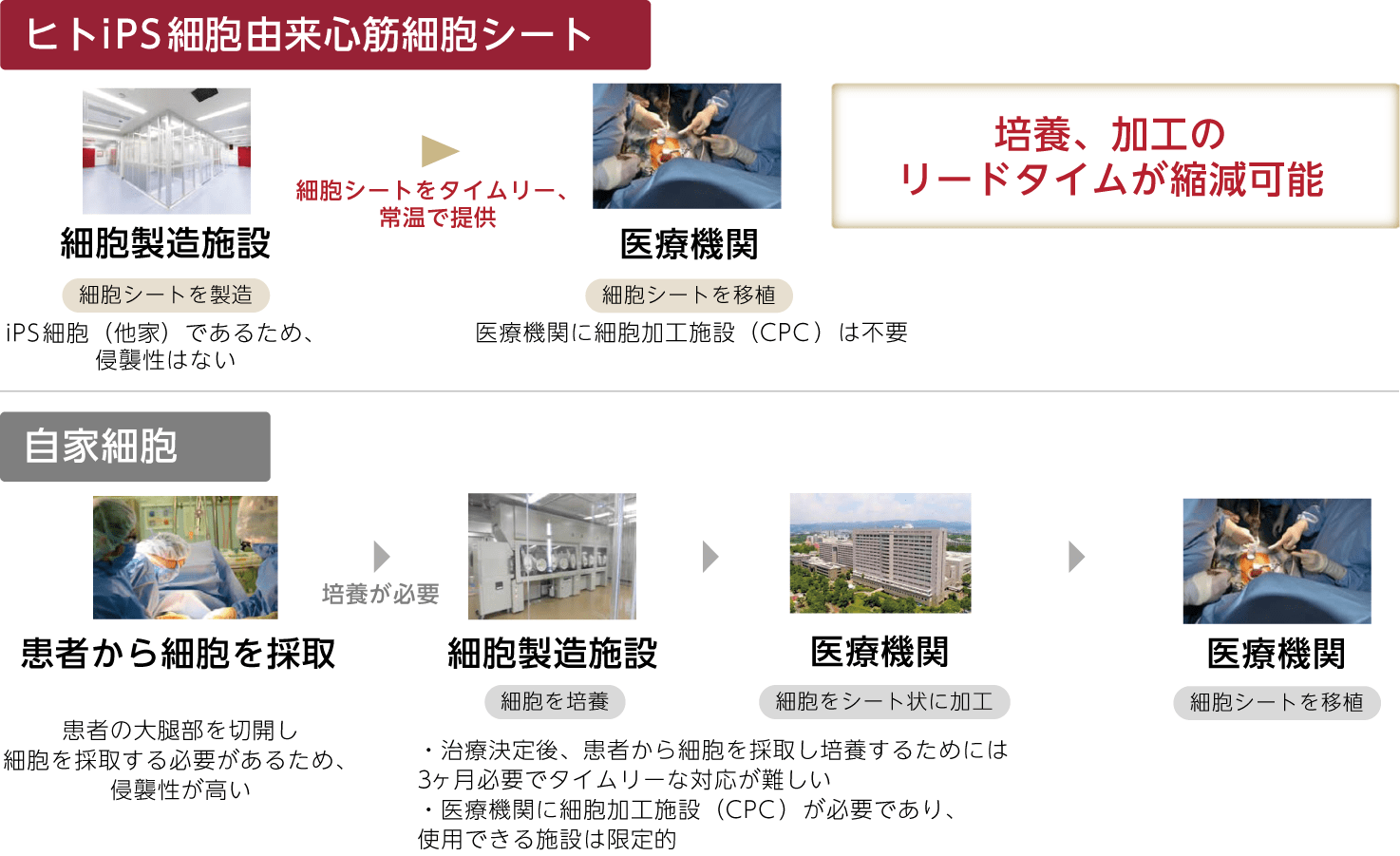
長距離輸送
凍結細胞の冷凍輸送ではなく、凍結細胞を解凍・培養してシート化した状態のまま通常の温度で輸送した場合でも、シート内の細胞が一定期間生存しており、例えば大阪府箕面市にある当社の商業用細胞培養加工施設「CLiC-1」から東京の医療機関まで新幹線等で輸送することが可能です。また、輸送する際にヒトiPS細胞由来心筋細胞シートを保護する役割を持つ輸送液にも独自の技術を有し、常温で2日程度の期間はシートの形状を保ったまま輸送することが可能となっております。これにより、日本国内全域のヒトiPS細胞由来心筋細胞シートを必要とする医療機関に確実に届けることが可能となっております。
さらに、当社が作製するヒトiPS細胞由来心筋細胞シートは、冷凍保存されずにシートの形状を保ったまま医療機関に輸送されるため、受け入れる医療機関側ではシートを軽く洗浄する程度で直ぐに移植可能となるという点で、大きな差別化が図れることとなります。

※ 当社の培養技術では、心筋のマーカーとして使用されている心筋収縮に必要な心トロポニン分子陽性細胞の比率が平均で95%です。
公表されている以下の論文(総説)で記載されている様々な手法における効率が8%から98%であることから、当社の効率は相対的に高く、高率であると記載しております(当社調べ)。
A review of protocols for human iPSC culture, cardiac differentiation, subtype-specification, maturation, and direct reprogramming
Davi M Lyra-Leite, Óscar Gutiérrez-Gutiérrez, Meimei Wang, Yang Zhou, Lukas Cyganek, Paul W Burridge
STAR Protoc. 2022 Aug 18;3(3):101560. doi: 10.1016/j.xpro.2022.101560.
Differentiating Human Pluripotent Stem Cells to Cardiomyocytes Using Purified Extracellular Matrix Proteins
Ashlynn M Barnes, Tessa B Holmstoen, Andrew J Bonham, Teisha J Rowland
Bioengineering (Basel). 2022 Nov 22;9(12):720. doi: 10.3390/bioengineering9120720
(4)研究開発パイプライン

※ICM向けiPS心筋シートは、治験プロセスがコホートA/Bの2つのプロセスに分かれております。2023/6時点でコホートA/Bで想定している患者の組み入れが全て完了しています
a.PJ1ヒトiPS細胞由来心筋細胞シート(対象疾患:虚血性心疾患(国内)
① 研究概要、対象領域
ヒトiPS細胞由来心筋細胞シートとは、ヒトiPS細胞から作製した心筋細胞を主成分とした他家細胞(※8)治療薬であり、シート状に加工された心筋細胞を心臓に移植します。心臓移植又は補助人工心臓の装着する段階まで悪化していない患者を対象とし、心機能の改善や心不全状態からの回復等の治療効果が期待されるものとなります。当社のヒトiPS細胞由来心筋細胞シートは、京都大学iPS細胞研究所(CiRA)から提供されたヒトiPS細胞を心筋細胞に分化誘導した後、精製加工することで未分化iPS細胞を除去した上で、シート化して、患者の心臓に直接貼付するものです。
薬剤等による内科的治療では回復が見込めない心臓病の患者への治療法は現在確立されていないため、時間の経過とともに症状が悪化し、最終的な治療手段として、補助人工心臓装置(VAD)(※9)の装着又は心臓移植に至ります。しかしながら、補助人工心臓装置はその耐久性や合併症の課題から長期使用には適さず、心臓移植については日本では臓器提供者が慢性的に不足していることに加えて他人の臓器に対する免疫拒絶反応等の問題があることから、重症心不全患者に対する新しい治療技術の実用化が大いに期待されています。
期待される効果(イメージ)

*1 AMI:Acute Myocardial Infarction(急性心筋梗塞)。
心臓の血管が詰まり血流が止まることで、心筋に酸素と栄養が十分に供給されなくなり、心筋が壊死した状態
*2 LVAD:Left Ventricular Assist Device(左室補助人工心臓)。
重度の心不全状態に陥った心臓の代わりとして、血液循環を補助するポンプ機能を補う医療機器
② ヒトiPS細胞由来心筋細胞シートのメカニズム
当社のヒトiPS細胞由来心筋細胞シートによる治療効果は、心筋梗塞モデル動物への心筋細胞シート移植後の心機能改善により確認されており、その作用メカニズムは、これまでに実施されたin vitro(試験管内)実験及び大小動物を用いたin vivo(生体内)実験に基づく数多くの基礎的研究から、以下に示すものと現在のところ推定されています。

*1 サイトカイン:細胞から分泌され、特定の細胞の働きに作用するタンパク質
*2 細胞外気質リモデリング:梗塞部位において組織の柔軟性がなくなり、組織の再生や修復が難しくなる線維化現象について、線維化の改善又は抑制するために、繊維となる細胞外気質を変革すること
*3 幹細胞の遊走:梗塞部位における組織の修復を担う幹細胞を遊走させ集積させること
*4 レシピエント心組織:レシピエントとは臓器移植等における臓器の受容側を指し、ここでは動物実験におけるヒトiPS細胞由来心筋細胞を受け入れた動物の心筋を指す
*5 電気的融合:梗塞部位における心機能を回復させるために、ペースメーカー細胞から拍動の電気信号を伝えるように断絶した心筋細胞を結合させること
- 移植されたヒトiPS細胞由来心筋細胞シートに特有の因子が産生されることにより、心筋梗塞を起こした部位の近傍からの血管新生を促進し、梗塞部位の修復に寄与していること(「パラクライン効果」)。
- 心筋細胞を主構成体とする心筋細胞シートが、移植後に患者の心臓と機能的及び電気的に結合し、患者の心臓と同期して収縮弛緩することにより、力学的に患者の心臓の機能をサポートしていること。
これらにより、休眠している心筋細胞に刺激を与え、活性化させることにより、心筋細胞の再生を目指すものです。
上記の期待する効果を得るためには、移植後一定期間(約3か月)、患者の免疫拒絶を回避し、心筋細胞シート内の細胞を生存させる必要があるため、免疫抑制剤の投与による一時的な拒絶反応の抑制が必要になりますが、免疫抑制剤を漸減することで治療効果を確保し、短期間で免疫抑制剤の投与を終了する治療方法が大阪大学で開発されています。
③ ヒトiPS細胞由来心筋細胞シートが有するメリット・デメリット
(デメリット)
- 他家移植の場合、自身の細胞に由来しない細胞を移植するため、患者の持つ免疫機能により拒絶反応が生じます。これを抑えるため、移植後一定期間は免疫抑制剤の投与が必要となり、その間、患者の免疫が低下し、疾病に罹患するリスクが上昇します。
- 他家移植により一度に多くの細胞を製造できる一方で、感染リスクを徹底的に排除するための厳重な試験検査、及び細胞保管のための冗長性のある設備やその管理が必要であり、コスト増の要因となります。
④ 進捗状況
医師主導治験は、予定被験者数を8症例とする試験デザインとなっております。
治験計画前半となるコホートA(ヒトに移植されることから慎重に進めるための前半フェーズ)では、計3症例の被験者に対して移植が行われる計画になっており、2020年1月に第1例目の被験者にヒトiPS細胞由来心筋細胞シートを移植し、2020年11月には第3例目の被験者まで移植を完了しています。大阪大学によるコホートAの移植実施報告がなされており(※12)、その後、コホートAの3症例の安全性や有効性の評価を、大阪大学内に設置され独立した評価を実施する効果安全性評価委員会が行っています。
コホートB(コホートAでの安全性及び有効性評価に応じて用量の増加を可能とするフェーズ)は、大阪大学医学部附属病院を始め、順天堂大学医学部附属順天堂医院、東京女子医科大学病院及び九州大学病院で移植を実施する多施設共同試験であり、計5症例の被験者への移植を完了しました。
この結果、8症例への移植がすべて完了しています。
現在、有効性や安全性を評価している段階にありますが、大阪大学の研究チームが第1症例を対象に詳細に有効性及び安全性について解析した結果、肯定的な評価を示唆する論文をインターネットサイト「medRxiv」(https://www.medrxiv.org/ )において発表しています(※14)。
有効性に関して、本論文では、当該患者の心機能の改善が認められ、心不全の重症度を表すニューヨーク心臓協会(NYHA)心機能分類のⅢ度(中等度)からⅡ度(軽度)への改善も示されました。
また、安全性に関しては、移植後6か月及び1年において、本移植を原因とする不整脈、心臓を含む全身における腫瘍の形成並びに免疫抑制剤による有害事象を含む合併症など、許容できない安全性上の問題は認められていません。

※1 期限付き承認制度:治験の対象患者の集積が難しいことや、対象製品の品質の不安定性などの理由で、臨床第Ⅲ相(PⅢ)試験などの検証的臨床試験の実施に長期間を要するような医薬品・医療機器・再生医療等製品について、少数例の治験データに基づき、安全性が確認され、一定の有効性が見込まれる製品を一定条件と期限を付したうえで早期に承認し、販売後有効性を評価することとする制度.。申請内容を踏まえてPMDAが適用を判断。
※2 コホートA:本製品が初めてヒトに移植されることから慎重に治験を進めるためのフェーズとして設定。用量の適切性を確認するためのフェーズ。大阪大学医学部附属病院の細胞製造施設で製造
※3 コホートB:コホートAの結果を踏まえて用量の増加を可能とするフェーズを設定。当社の細胞培養加工施設(CLiC-1)で製造
※4 効果安全性評価委員会:治験依頼者又は自ら治験を実施する者とは独立した立場から、治験の継続、変更、中止、中断等の提言を行う委員会
※5 コホートAでの移植を受けて、効果安全性評価委員会で効果の安全性・有効性を評価した上でコホートBに進んでいます
⑤ 心疾患の市場規模概算
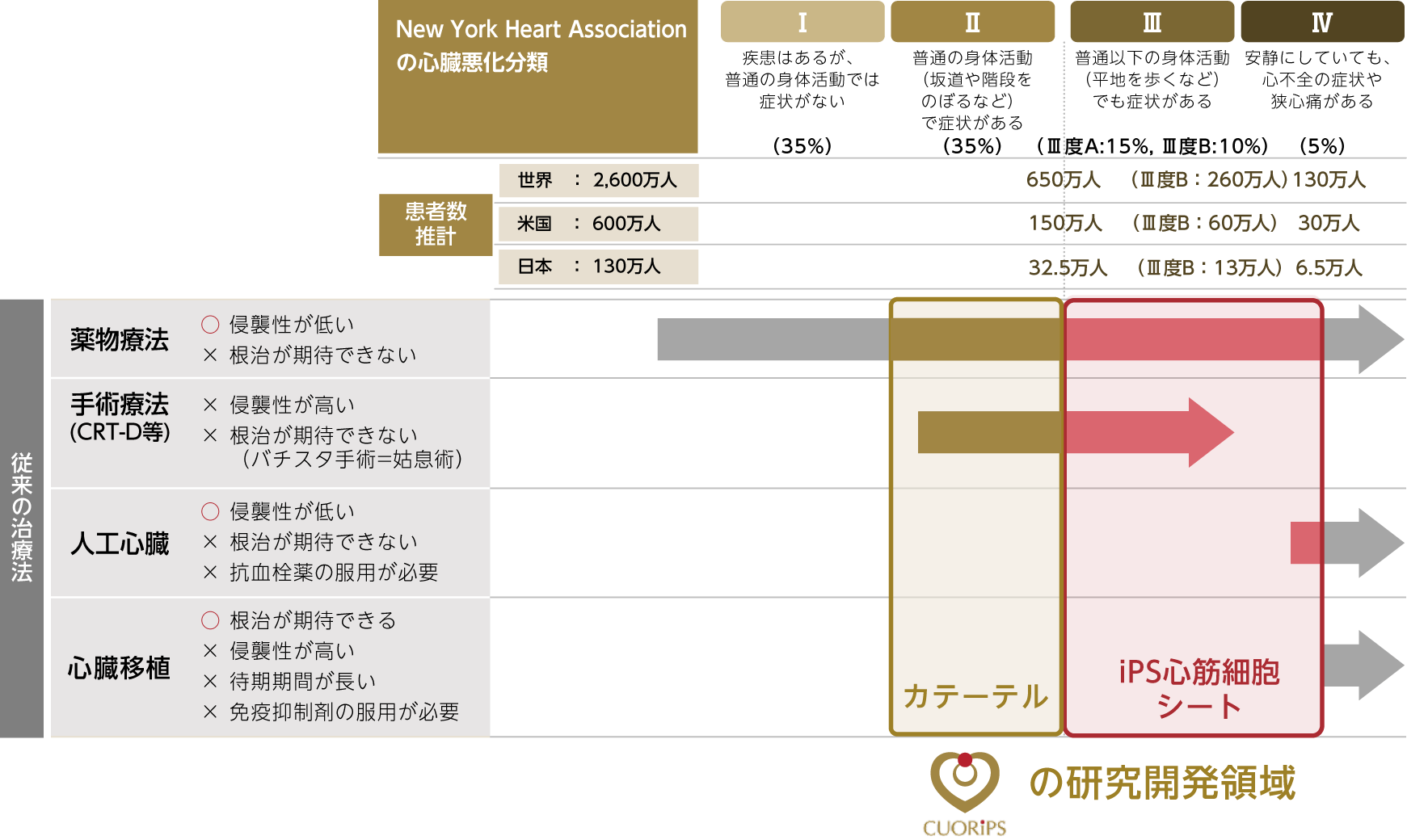
当社のヒトiPS細胞由来心筋細胞シートの対象患者は、虚血性心疾患で内科的な治療では心臓の悪化を防ぐことができず、心臓移植又は補助人工心臓の装着まで悪化していない患者で、NYHA(※11)心機能分類Ⅲ度の後期(Ⅲ度B)及びⅣ度の初期の患者です。心不全患者のうち、NYHA心機能分類でⅠ度の患者の割合は35%、Ⅱ度は35%、Ⅲ度は25%(Ⅲ度Aは15%、Ⅲ度Bは10%)、Ⅳ度は5%存在すると推定されています(Miller LW. (2011). Left Ventricular Assist Devices Are Underutilized. Circulation, 123, 1552–1558.)。公益財団法人日本心臓財団によると、2015年時点で日本での心不全患者数は、全体で130万人であるため、NYHA心機能分類Ⅲ度の患者数が32.5万人、Ⅳ度が6.5万人と推定されます。同様の推定を米国及び全世界において行うと、米国での心不全患者数は600万人であるため、NYHA心機能分類Ⅲ度の患者数が150万、Ⅳ度が30万人と推測されます。また、全世界ベースでは心不全患者数が2,600万人であるため、NYHA心機能分類Ⅲ度の患者数650万人、Ⅳ度が130万人と推測されます。(Savarese G, Lund L.H. (2017). Global Public Health Burden of Heart Failure. Card Fail Rev., 3(1), 7–11.)
PJ2 ヒトiPS細胞由来心筋細胞シート(対象疾患:拡張型心疾患(国内))
ヒトiPS細胞由来心筋細胞シートの適用対象を拡大するため、拡張型心疾患を効能追加するための研究開発を計画しております。拡張型心疾患の進行や終末は、虚血性心疾患と同様に、微小循環を含む心筋組織の虚血による心筋細胞の肥大化や線維化であり、これらが進行することで心機能が低下する状態となるため、ヒトiPS細胞由来心筋細胞シートの治療メカニズムから見て効果があるのではないかと考えられるためです。現在は、DCMモデル動物を用いたヒトiPS細胞由来心筋細胞シートの有効性を元に大阪大学が進める医師主導治験のプロトコル設計を支援しており、虚血性心疾患を対象としたヒトiPS細胞由来心筋細胞シート(PJ1)に効能追加を行うことを目指しております。
PJ3 ヒトiPS細胞由来心筋細胞シート(対象疾患:虚血性心疾患(海外))
PJ1と同様の適用対象である虚血性心疾患を対象としたヒトiPS細胞由来心筋細胞シートを、国内だけでなく販売地域を拡大し、アメリカ及び欧州で製造販売承認の取得を計画しております。現在は、海外での開発拠点の準備・体制整備、開発プランの策定及びアライアンス先の選定を行っております。
PJ4 カテーテル
軽度の心臓疾患に対応するパイプラインとして、カテーテルによる新たな血管内アプローチによりヒトiPS細胞由来細胞を心臓へ移植する治療技術を、朝日インテック株式会社との共同開発(※17)を進めております。同社が有するカテーテル製品開発技術と当社のヒトiPS細胞由来細胞の開発を組み合わせることにより、新しい治療技術を創出します。
PJ5 体内再生因子誘導剤
小野薬品工業株式会社が開発をした医薬品用低分子化合物であるオキシム誘導体(YS-1301)を低用量使用することにより、組織の再生を促進する各種体内再生因子(肝細胞増殖因子(HGF)、血管内皮増殖因子(VEGF)、ストローマ由来因子(SDF-1)(※21)、骨髄細胞動員因子(HMGB1)等)が誘導される薬理作用に基づき、細胞保護、抗線維化、抗炎症作用による血管新生、組織再生が期待されます。肝硬変・非アルコール性脂肪肝炎(NASH)(※22)、閉塞性動脈硬化症(ASO)(※23)、慢性腎不全(CKD)(※24)、慢性閉塞性肺疾患(COPD)(※25)等への治療薬としての開発を目指します。
(5)CDMO事業
ヒトiPS細胞由来心筋細胞シートの研究開発・事業化を通じて培った大量培養技術・ノウハウ及び独自の設計コンセプト(特許出願中)に基づき効率的かつ実効的な最先端の商業用細胞培養加工施設「CLiC-1」を活用し、様々な細胞製品のCDMO事業にも取り組んでまいります。CLiC-1は、上記の独自設計コンセプトに加え、製造プロセス開発や非臨床細胞製造が可能なラボを併設しており、これらの施設や技術ノウハウを最大限に活用した製造プロセス開発から非臨床、臨床試験、商用製造までを一貫してワンストップで進めることを可能としております。
用語解説
| ※1 | 分化誘導 | 幹細胞を異なる細胞種に変化させること。 |
| ※2 | 骨格筋芽細胞 | 骨格筋内に存在する未分化性の細胞であり、発生期や再生期に増殖して筋細胞に分化する細胞。 |
| ※3 | 治療モダリティ | 治療技術や手段の意味。モダリティは「様式」といった意味があるが、医療分野では、技術の方法や手段の分類を指す。 |
| ※4 | 医師主導治験 | 製薬企業が主体的に行う企業治験に対して、医師が自ら治験を行うこと。2003年の薬事法改正により、医師主導治験が可能となっている。医師主導治験においても、企業が治験薬や資金等を提供するなどの支援は可能であるが、治験準備から試験の実施、試験結果の結論付けなどは治験責任医師が実施することであり、治験の根本に係るプロセスに企業は関与しないことが原則である。したがって、治験を実施した医師等が報告・公表するまで、企業は試験の実施状況や結果などの情報を得ることは困難である。 |
| ※5 | 局所制御技術 | 開口部に扉を設けないことで、開口部からブース外へ一方向の気流を形成させ、再生医療等製品の製造を行うエリアを高い清浄度に保つ技術。ダイダン株式会社が開発したクリーンブースに当該技術が導入されている。 |
| ※6 | サイトカイン | さまざまな細胞から分泌され、特定の細胞の働きに作用するタンパク質。 |
| ※7 | レシピエント心筋 | レシピエントとは、臓器移植等における臓器の受容側を指す。この場合、動物実験におけるヒトiPS細胞由来心筋細胞を受け入れた動物の心筋。 |
| ※8 | 他家細胞 | 患者以外の別の方の細胞。他家細胞に対し、患者自身の細胞は自家細胞という。 |
| ※9 | 補助人工心臓装置(VAD) | 様々な原因により急性あるいは慢性の経過から重度の心不全状態(急性心原性ショックを含む)に陥ってしまった心臓の代わりとして、血液循環を補助するポンプ機能を補う医療機器。VADは、Ventricular Assist deviceの略。 |
| ※10 | 侵襲 | 医学的には、生体の恒常性を乱す事象のこと。怪我、病気に加え、手術、投薬等の医療行為による影響を意味する。 |
| ※11 | NYHA | ニューヨーク心臓協会(New York Heart Association)の略称。 NYHA心機能分類は、NYHAが心機能を重症度に応じて、以下の四つに分類したもの。 I度:心疾患を有するが、そのために身体活動が制限されることのない患者 Ⅱ度:心疾患を有し、安静時には無症状であるが、通常の活動で疲労、動悸、呼吸困難、狭心症になる患者 Ⅲ度:心疾患を有し、身体活動が高度に制限される患者、即ち、通常以下の活動で疲労、動悸、呼吸困難、狭心症になる患者 Ⅳ度:非常に軽度な活動乃至安静時でも心不全乃至狭心症を起こす患者 |
| ※12 | 大阪大学における報告 | 2020年12月25日付の同大学発表ニュースリリース https://www.med.osaka-u.ac.jp/archives/24240 |
| ※13 | 順天堂医院における移植事例 | 2022年9月12日付の同院発表ニュースリリース https://med.juntendo.ac.jp/news/20220912-02.html |
| ※14 | 「medRxiv」論文 | https://www.medrxiv.org/content/10.1101/2021.12.27.21268295v1.full |
| ※15 | 「Frontiers in Cardiovascular Medicine」論文 | https://www.frontiersin.org/articles/10.3389/fcvm.2022.950829/abstract |
| ※16 | FDG-PET | フルオロデオキシグルコース(FDG。放射性フッ素を付加したブドウ糖)を使った癌検査方法。PETはPositron Emission Tomography(陽電子放射断層撮影)の略。FDG-PET/CTは、FDG-PETにCT検査を融合させた癌検査方法。CTはComputed Tomography(コンピュータ断層撮影)の略。 |
| ※17 | 朝日インテック株式会社との共同開発 | 2022年4月12日付の同社発表ニュースリリース http://www.asahi-intecc.co.jp/r/2977/ |
| ※18 | 急性心筋梗塞(AMI) | 心臓の血管が詰まり血流が止まることで、心筋に酸素と栄養が十分に供給されないことで心筋が壊死した状態となる病気。体内に酸素等が十分に供給されなくなることで、致死的な状態となる可能性がある。AMIはAcute myocardial infarctionの略。 |
| ※19 | 慢性完全閉塞性病変(CTO) | 心臓の冠動脈が3か月以上にわたり完全に閉塞し、血流が止まっている状態。 CTOはChronic Total Occlusionの略。 |
| ※20 | 経皮的冠動脈インターベンション(PCI) | 虚血性心疾患に対して、冠動脈内腔の狭窄部分にカテーテルを使用して拡張する治療法。PCIはPercutaneous Coronary Interventionの略。 |
| ※21 | ストローマ由来因子(SDF-1) | ストローマ(Stromal Cell)とは、臓器の結合組織の細胞であるストローマ細胞を指す。ストローマ細胞から派生する因子の意。SDFはStromal Cell-Derived Factorの略。 |
| ※22 | 肝硬変・非アルコール性脂肪肝炎 (NASH) | 非アルコール性脂肪性疾患の一部。脂肪変性、炎症、肝細胞障害等を伴う。病状が進行した場合、肝硬変や肝臓がんにもつながる。NASHはNonalcoholic Steatohepatitisの略。 |
| ※23 | 閉塞性動脈硬化症(ASO) | 手足の血管動脈の硬化が進行し、狭窄や閉塞が発生することにより、血流が悪化する病気。手足に酸素、栄養分の供給が不足することとなり、冷感、しびれ感、間歇性跛行(歩行中の足の痛み)、疼痛、潰瘍、壊疽等の症状が発生し、症状が進行した場合には、手足の切断に至る場合もある。ASOはArterio-Sclerosis Obliteransの略。 |
| ※24 | 慢性腎不全(CKD) | 腎臓の機能が低下し、老廃物を十分に排泄できなくなった状態。病状が進行した場合、定期的な透析や腎臓移植が必要となる。CKDはChronic Kidney Diseaseの略。 |
| ※25 | 慢性閉塞性肺疾患(COPD) | タバコ等の有害物質を長期吸引することで発症する病気。以下のような症状を伴う。① 気管支に炎症がおき咳や痰が出る、気管支が細くなることによって空気の流れが低下する。② 気管支の奥にあるぶどうの房状の肺胞が破壊され、酸素の取り込みやCO2の排出する機能が低下する。COPDはChronic Obstructive Pulmonary Diseaseの略。 |
| ※26 | ドラッグリポジショニング | 既存薬再開発とも言う。開発済の薬や化合物を、別の疾患治療用に開発を行うもの。ゼロから開始する新薬開発に比べ、安全性や危険性が明らかになっていること、開発にかかる費用の削減や時間の短縮が可能となること等の利点があげられる開発手段。 |
